El Oxígeno y las Hemo-proteínas: una danza estudiada por simulación
Osvaldo Chara. Instituto de Física de Líquidos y Sistemas Biológicos (CONICET - UNLP).
Las hemo-proteínas son, como su nombre lo indica, proteínas, que poseen un grupo químico llamado hemo que se encuentran muy difundidas en todos los organismos vivos. Se encargan de una amplia variedad de tareas: desde el transporte de electrones hasta oxidación de moléculas orgánicas y el sensado y transporte de pequeñas moléculas que suelen estar en estado gaseoso. Entre estas, principalmente, Oxígeno (O2), Monóxido de Carbono (CO) y Monóxido de Nitrógeno (NO).
El Oxígeno es el más abundante de estos tres ligandos (esta palabra hace referencia a que la Hemo-proteína establece una suerte de “ligadura” con cada uno de estos compuestos) y, al mismo tiempo, es el que tiene la menor afinidad por el grupo hemo libre (es decir, el grupo hemo sin formar parte de una Hemo-proteína). De este modo, la sutil regulación de la afinidad del Oxígeno es entonces uno de los problemas clave para determinar la función de una hemo-proteína.
Un trabajo reciente de Luciana Capece y colaboradores (2006), del grupo de Darío Estrin, en el INQUIMAE, Facultad de Ciencias Exactas y Naturales, UBA abordó este problema empleando simulación por Dinámica Molecular. En la mayoría de las hemo-proteínas el sitio activo, dónde se une el Oxígeno, consiste en una cavidad ubicada sobre el grupo hemo, conocida como bolsillo distal (distal pocket en inglés). El grupo hemo posee un átomo de hierro coordinado ecuatorialmente por los cuatro nitrógenos del macrociclo porfirínico que conforman el anillo hemo y, axialmente a un quinto nitrógeno o ligando proximal bajo el anillo hemo. Este ligando proximal puede ser uno de los siguientes tres aminoácidos: histidina (Hys), cisteina (Cys) o tirosina (Tyr).
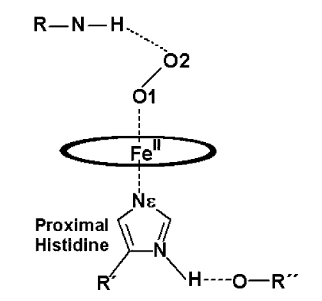
Trabajos previos investigaron la influencia de residuos en la región distal que establecían puentes de hidrógeno con el uno de los átomos de Oxígeno de la molécula de Oxígeno (ver parte superior de la Figura 1). Se ha encontrado que, en general, cuanto mayor es la posibilidad de que el Oxígeno pueda interaccionar con un residuo distal, menor es la tasa de disociación de la molécula de Oxígeno con la Hemo-proteína, y, por lo tanto, mayor sería la afinidad. No obstante, hay una excepción interesante: la leg-hemoglobina (Lb).
Al igual que las hemo-proteínas que encontramos en mamíferos, como la mioglobina (Mb), la Lb - que se encuentra en las leguminosas - posee una histidina en la cavidad distal. Ahora bien, un reemplazo de esta histidina por un residuo que no pueda formar un puente de hidrógeno disminuye 100 veces la afinidad del Oxígeno por la Mb, mientras que no cambia prácticamente la afinidad del Oxígeno por la Lb. Posiblemente, la causa de esta diferencia entre el cambio de afinidad entre el oxígeno y la hemo-proteína se deba a la interacción con residuos proximales (ver parte inferior de la Figura 1). El estudio de este problema es, en principio, accesible por simulación computacional.
Para ciertos fenómenos que no involucran formación o ruptura de enlaces covalentes se pueden emplear simulaciones de dinámica molecular empleando una función de energía potencial clásica Este tipo de simulación consiste, esencialmente, en resolver las famosas ecuaciones en las que están escritas las leyes de Newton para cada uno de los átomos de las moléculas que conforman el sistema a estudiar: la hemo-proteína y el Oxígeno. Por otra parte, es preciso emplear herramientas basadas en la Mecánica Cuántica para describir la energía potencial en situaciones en las cuales si existe formación o ruptura de enlaces químicos.
El empleo de estas herramientas está limitado por razones computacionales en el tamaño de los sistemas a ser estudiados a unas pocas decenas de átomos, por lo que resultaría imposible modelar una proteína. Por esta razón, el grupo de Darío Estrin investigó este problema utilizando un esquema que emplea un modelo de energía potencial híbrido que combina la mecánica cuántica para el sitio activo de la proteína y un potencial clásico para el resto de la misma (QM-MM). Empleando estas herramientas, el grupo de Darío Estrin pudo poner de manifiesto que las interacciones debidas a los residuos proximales pueden “sintonizar” la afinidad del Oxígeno por la hemo-proteína.
Referencia: Capece, L., Marti, M.A., Crespo, A., Doctorovich, F & Estrin, D.A. 2006. Heme Protein Oxygen affinity regulation exerted by proximal effects. J. Am. Chem. Soc. 128: 12455-12461.