BNCT: Neutrones, Aceleradores y Oncología
Diego Vallejo: Facultad de Ingeniería - Universidad Nacional de La Plata. En colaboración con Sandra Maguid, Universidad Nacional de Quilmes.
Este artículo ha sido financiado por el proyecto INVOFI de la Asociación Física Argentina.
Cáncer: un conjunto de enfermedades que desequilibran el control celular. Aparecen células que se multiplican en exceso y adquieren carácter maligno. Al cáncer lo sufren los que lo padecen y los que están cerca de los que lo padecen. Google devuelve casi 300 millones de páginas relacionadas con esa palabra. El cáncer es siempre noticia, a veces es susurro y otras veces es política: en 1971 Richard Nixon (entonces presidente de los Estados Unidos) se tomó un momento para declararle “norteamericanamente” la guerra al cáncer, con las siguientes palabras:
“Ha llegado el momento en Norteamérica en que el mismo tipo de esfuerzo mancomunado que logró dividir el átomo, y llevar al Hombre a la Luna, debe dirigirse a la conquista de esta terrible enfermedad”

Pero aquí, en Argentina, en la Comisión Nacional de Energía Atómica, lejos de las declaraciones rimbombantes, el Dr. Andrés Kreiner, Jefe del Grupo de Espectroscopía Nuclear, trabaja junto con otros científicos en una terapia alternativa para la enfermedad. Nos recibe amablemente en su laboratorio del Centro Atómico Constituyentes y nos introduce en un sector amplio, con mobiliario electrónico, multitud de llaves, botones y controles que deslizan sobre escalas graduadas. Y todo ocurre casi tranquilamente, en medio de un trabajo que no se detiene.
Terapias y límites
¿Cuál es el ideal de un tratamiento oncológico? Sin duda, destruir o detener todas las células malignas sin causar daño a las sanas. Las terapias usuales por radiación gama funcionan con tumores localizados. Sin embargo, en el caso de los melanomas y los glioblastomas, el éxito de las técnicas convencionales es limitado. En palabras de Kreiner: –Hay cánceres geométricamente difusos, hay células "guerrilleras" que infiltran el tejido normal circundante. El volumen afectado no está bien definido. Si el tumor es infiltrante y difuso, esa estrategia [la de los rayos gama enfocados] fracasa.
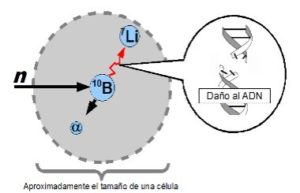
Un tratamiento alternativo en el que trabaja el equipo de Kreiner es la Terapia por Captura Neutrónica en Boro (BNCT). –La idea fue propuesta por Gordon Locher en 1936, poquito tiempo después del descubrimiento del neutrón, que fue en 1932 –refiere. Hay dos etapas en el BNCT: primero se inyecta al paciente una sustancia, que contiene boro 10, un elemento no tóxico, no radiactivo. Esta sustancia debe ser afín a las células cancerosas. En el caso ideal, el boro es absorbido por todas las células tumorales y no por las células sanas.
En la segunda etapa se irradia con neutrones, los que son capturados con alta eficiencia por el boro. Entonces ocurre una reacción nuclear y se emiten dos partículas: un núcleo de litio y una partícula alfa. Al recorrer su camino dentro del tejido vivo y frenarse el litio y la particula alfa producen un gran daño biológico. Nos dice Kreiner: –Esa es la ventaja del BNCT: que toda la radiación queda localizada en la célula que tiene boro. [...] Los rangos [donde queda la radiación] son entre 5 y 10 micrones, del tamaño típico de una célula. Y agrega: –Uno busca producir daño al ADN para impedir que prolifere, para esterilizar [la célula cancerosa]. Estas partículas producen un daño muy complejo. Para ejemplificarlo, en vez de romper una cadena, rompe las dos del ADN. Y el tejido vivo [que incluye a las células malignas] no tiene medios eficientes para reparar este daño. Y así se destruyen o dejan de proliferar las células malignas, que es lo que uno quiere.
–¿Qué es lo que demora tanto la implementación del BNCT? –La idea es genial, pero la implementación práctica está llevando muchísimo tiempo. Por muchos motivos. Uno fue obtener una droga suficientemente selectiva [la sustancia que transporta al boro]. Y además se irradiaba a los pacientes con haces de neutrones térmicos, que se absorben desde la superficie, en el hidrógeno y el nitrógeno, entonces todo el tejido anterior recibía mucha más dosis que el propio tumor. Eso hizo que esta técnica fracasase. Después de unos cuantos años la gente dijo "no usemos neutrones térmicos sino epitérmicos", que tienen 10 keV y eso hace que pueda penetrar el haz sin ser absorbido, que se termalice en el propio tejido y llegue térmico al tumor donde está el boro. Son varias cosas que la gente trabajosamente fue aprendiendo.
Entender el efecto
¿De qué depende el éxito del BNCT? ¿Cuáles son las condiciones para que sea efectivo? –Cuéntenos cómo se evalúa el efecto específico del litio y de la particula alfa. –Irradiamos cultivos celulares con haces de litio, cuya energía podemos fijar. Podemos fijar la dosis, podemos fijar claramente las condiciones de trabajo. Y medir la eficacia biológica relativa, que es el parámetro que sirve para comparar el efecto de diferentes iones relativamente a la radiación gama, que es la radiación de referencia porque se usa en radioterapia convencional.
–¿Y respecto a la distribución de boro? ¿La sustancia que lo transporta logra llevarlo a las células cancerosas? –Hemos utilizado el microhaz de iones pesados del Laboratorio, y hemos estudiado dentro del tejido cómo se microlocaliza la droga.

Andrés Kreiner hace una pausa. Escucha los comentarios de otros investigadores, se excusa brevemente y se reúne con su equipo. Argumenta, evalúa la marcha de la experiencia que está ocurriendo. Luego vuelve y continúa explicándonos. –La muestra es un corte muy delgado de un tejido tumoral de un hámster previamente inyectado con el compuesto de boro cuya microdistribución queremos estudiar. Con un haz de oxígeno uno barre la muestra. Esto produce rayos X característicos, que se generan en el cobre del compuesto químico que contiene al boro. Esto me permite detectar trazas y saber dónde está y cuánto boro hay en cada punto de la muestra. Son intentos de ir entendiendo el problema. Tratar de predecir el efecto radiobiológico del tratamiento. Una vez que los especialistas pueden evaluar y entender el efecto en tejidos de animales de laboratorio, disponen de modos específicos de trasladar ese conocimiento a los efectos en tejidos humanos.
Neutrones y Aceleradores
–Háblenos del problema de los neutrones. –Hasta ahora el BNCT se hace sólo en reactores porque en nuestra civilización es la única fuente de neutrones de que disponemos –explica Kreiner y agrega: –Llevar pacientes a un reactor no es lo ideal... y tampoco lo es llevar reactores a un hospital. Entonces lo que nosotros estamos tratando de hacer es desarrollar un relativamente pequeño acelerador capaz de ser instalado en un hospital y que sea generador de neutrones. Un haz de protones incidiendo sobre un blanco conveniente produce una reacción nuclear que genera neutrones. Y esos neutrones son los que queremos utilizar para el BNCT.
–Está el tema del costo, no es lo mismo hacer un reactor que un acelerador, ¿no? –Sí, y muy a favor del acelerador. Un reactor nuclear es un aparato enormemente complejo, con un costo de inversión muy grande, con problemas de seguridad radiológica importantes, con uranio... y un acelerador es un aparato que uno desenchufa y se acabó la radiación.
–¿Y si uno quisiera comprarlo, de qué valor estamos hablando? –"Cuando" se desarrollen... porque hoy en día no se puede comprar. No hay ningún acelerador en ningún lugar del mundo que produzca la cantidad y la calidad de neutrones para BNCT. Hay gente que está trabajando hace tiempo en esto. Por ejemplo en Japón, en Italia, en Rusia –y agrega con entusiasmo– y nosotros estamos corriendo esa carrera. Kreiner nos explica que últimamente hay cambios en el paradigma del BNCT. Tradicionalmente se pensaba que el boro debía dopar todas las células malignas. Sin embargo se está evaluando que si el boro se localiza en los vasos que irrigan al tejido tumoral, que tienen elevada radiosensibilidad, también podría prevenirse su proliferación. Este conocimiento fue adquirido en nuestro país por la Dra. A. Schwint, colega de la CNEA.
Aplicación exitosa
–¿En algún caso se aplicó BNCT exitosamente? –Está en desarrollo. La droga está en el límite de selectividad aceptable. En Japón [...] algunos pacientes se han tratado con efectos impresionantes. He visto fotografías de personas con tumores de cabeza y cuello inoperables. Recibieron una sola aplicación de menos de una hora, frente a las repetidas aplicaciones en radiación gama. Después de unos meses la cara estaba totalmente limpia. Pero agrega con cautela: –Tiene una efectividad limitada, porque la droga no es óptima, también en cada paciente el efecto es diferente, la concentración en tejido no es la misma. Hay una variabilidad muy grande propia de cada organismo en particular. Acá en la Argentina se está aplicando con reactores, sobre melanomas de extremidades, brazos y piernas, que no implica riesgo para el paciente, y el control local de los nódulos melanóticos es muy bueno. Lo que pasa es que a los melanomas, una vez que proliferan, no hay manera de pararlos. Es decir, el control local es muy bueno, pero la enfermedad reaparece en otros lugares.

–En síntesis –concluye Kreiner– el juego es: primero cargar todas las células tumorales con boro y lo menos posible el tejido sano, y luego irradiar con neutrones. Es una terapia binaria. El tema es: utilizar una droga que tenga una selectividad particular en relación al tumor, y después una máquina chiquita, instalable en un hospital, disponible las 24 horas para poder desarrollar BNCT en el medio idóneo, que es una institución dedicada al cáncer, donde están los médicos y la infraestructura médica adecuada. Trabajamos en relación con el Centro Médico Vidt y el Instituto Roffo.
Para mayor información: http://www.tandar.cnea.gov.ar/