Atracción y desorden entre proteínas y fosfolípidos: Un estudio experimental de termodinámica de superficies
Los fosfolípidos que conforman las membranas celulares son capaces de interaccionar con proteínas pertenecientes a estas mismas membranas y con otras provenientes del exterior o del interior celular. Un ejemplo de estas últimas es una proteína producida por el oncogen c-fos. La palabra “oncogen” hace referencia a un gen que regula la transcripción de genes involucrados en el crecimiento normal o patológico de las células. Se sabe que este oncogen tiene un papel como modulador de la síntesis (generación) de fosfolípidos.
Por otro lado, se sabe que esta proteína c-Fos es capaz de “discernir” entre los fosfolípidos de acuerdo a la estructura de la cabeza polar y su carga. Estudios detallados muestran que este “discernimiento” molecular se debería a que la fuerza impulsora termodinámica sería diferente entre cada par (fosfolípido/c-Fos). De este modo, el c-Fos podría participar en la transducción de información molecular a nivel de la membrana de una célula. Se sabe que c-Fos exhibe interacciones no ideales, dependientes de la composición, con dos fosfolípidos: Fosfatidil Colina (PC) y Fosfatidil Inositol -4,5 di-Fosfato (PIP2).
En el reciente trabajo de Graciela A. Borioli y Bruno Maggio (2006), del Departamento de Química Biológica-CIQUIBIC, Facultad de Ciencias Químicas de la Universidad de Córdoba-CONICET, se propone estudiar el tipo de interacciones que establecen la proteína c-Fos con los lípidos PC y PIP2. Como se verá a continuación, en la interacción entre lípidos y proteínas, algunas veces gana la entropía y otras tantas la entalpía.
En el trabajo de Borioli y Maggio (2006) se analizó en detalle la termodinámica de superficie de films formados con mezclas binarias de c-Fos con PIP2 y con PC en diferentes proporciones evaluando la energía libre superficial, el empaquetado molecular, la composición lípido-proteína y la electrostática superficial. La disección de la energía libre en dos componentes (entropía y entalpía) permite profundizar en la energética de las interacciones proteína-lípido en una superficie. La entropía da una idea del desorden del sistema proteína-lípido mientras que la entalpía da una idea de la fuerza de la interacción entre la proteína y los lípidos.
Los autores realizaron experimentos en los que se medía tanto el potencial eléctrico superficial como la variación de presión superficial necesaria para expandir o comprimir un área de fosfolípido esparcido sobre la superficie de una solución, a temperatura constante. Encontraron que el comportamiento de las mezclas lípido/c-Fos se desvían de la idealidad, dependiendo del lípido, de la historia del sistema y de la proporción de la proteína en el film. Borioli y Maggio calcularon la energía libre, entropía y entalpía superficiales ideales y de mezcla. A partir de estas obtuvieron la energía libre, entropía y entalpía superficiales de exceso. Los pares proteína/lípido mostraron histéresis; es decir que la energía libre de exceso superficial durante la compresión era distinta que durante la expansión. Interesantemente, tanto la entalpía como la entropía de exceso superficial mostraron un comportamiento siempre creciente con la concentración del fosfolípido cuando este era PC y un comportamiento más complicado cuando este era PIP2 (ver Figura 1).
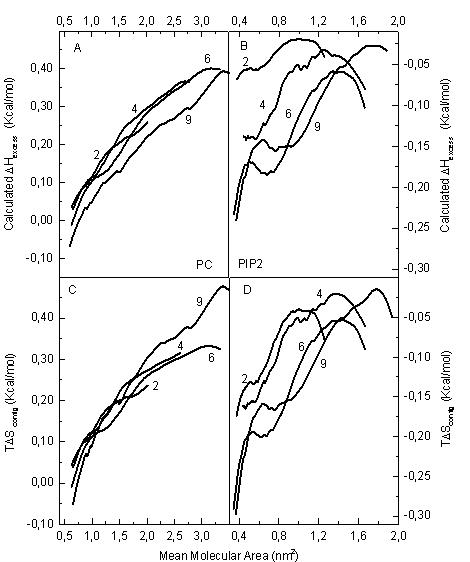
El balance entre entropía y entalpía de exceso fue diferente en el par c-Fos/PC comparado con el par c-Fos/PIP2. En efecto, la interacción electrostática entre c-Fos y PIP2, “pagada” por la interacción electrostática dipolar entre las dos moléculas, cubrió holgadamente el ordenamiento entrópico desfavorable. Por el contrario, el desorden configuracional generado por el par c-Fos y PC supera la interacción entre estas dos moléculas.
Los hallazgos experimentales de los autores indicarían que las interacciones entre c-Fos y los fosfolípidos involucrarían diferentes compensaciones entálpicas-entrópicas que podrían dar cuenta del comportamiento experimental observado. De este modo, el par c-Fos/fosfolípidos emergería como una poderosa, sensible y selectiva maquinaria molecular auto-organizada bidimensional capaz de traducir cambios estructurales interfaciales.
Trabajo original: Borili, G.,A. & Maggio, B. Surface thermodynamics reveals selective structural information storage capacity of c-Fos-phospholipid interactions. Langmuir, 22. 1775-1781. 2006.